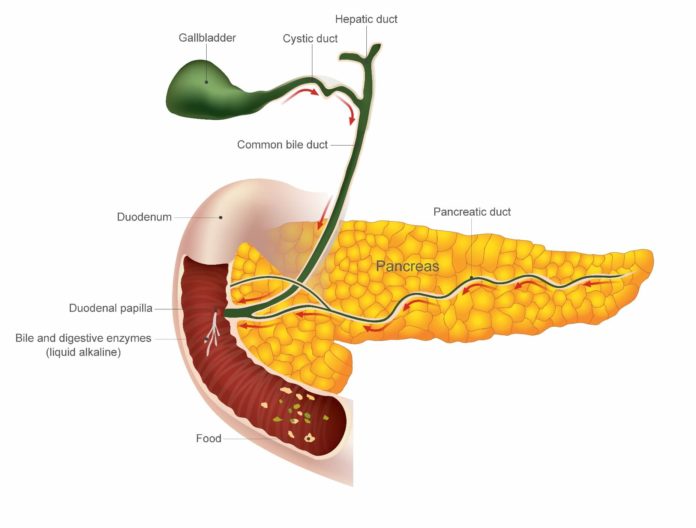
過去台灣生醫產業推動的政策包括;強化Google、IBM等科技大廠對台連結,建立合作夥伴關係,關創跨域或跨業的新型態合作模式;以及新藥與新醫材持續進入國際市場和啟動國家生技研究園區營運與進駐等。
而今年全球受到新冠肺炎疫情的衝擊,生醫人才輩出的台灣反而逆勢而起,組成檢測和疫苗國家隊,步上國際舞台。其中再生醫學已經成為新一波生技產業創新轉型的驅動力!
打造再生醫療有利環境
為了再生醫療產業能夠接軌國際,經濟部工業局呂正華局長提出:落實精準健康,從政策、審查、產業及醫療端打造再生醫療有利環境的新方向!呂正華局長表示,再生醫療是落實精準健康重要的一環,至2020年8月為止,目前台灣發展再生醫療的廠商超過50家,為確保再生醫療品質與建置有利發展環境,亟須政策端、審查端、產業端及醫療端的各方合作。
需要導入IT技術

台灣醫界聯盟基金會林世嘉執行長指出,再生醫療不只帶動生物醫學的突破,自動化設備裝置、冷鏈物流都需要最新IT技術的導入。「特管辦法」所累積的寶貴經驗將充實並提升環境,產品的把關與推動仍有待「再生醫療製劑管理條例」的通過,不少與會者詢問法案進展。惟有將檯面下進行的治療透過法規正式納管,才能鼓勵有品質、有療效的產品上市,使整體醫療品質上升,最終是全民獲利。
建立審查、產業及醫療端
在審查端,醫藥品查驗中心黃玉芬專案經理說明再生醫療產品臨床試驗申請程序,包含GTP訪查及TFDA再生醫療諮議小組等審查中的人、地、時、物等注意事項,透過嚴格的審查確保民眾接受到安全的治療。

三顧公司陳建彰經理分享細胞製備場所(CPU)的品管經驗,細胞治療產品與傳統藥物不同,細胞是活的,因此必須將製造過程即視為產品嚴格把關,包含人員、倉管、設施、設備、品管、資料管理、環境管理等,都應建立細緻且精準的標準程序。
花蓮慈濟醫院基因暨幹細胞研製中心孫立易主任指出,身為東部唯一一間申請「特管辦法」的醫院,花蓮慈濟醫院已通過7件計畫,預計年底再通過4件。為確保提供最佳品質的再生醫療,建議醫院應有單一窗口,便於溝通;對內有專人管理、規畫及追蹤;療程設計應符合醫院既有的設備及習慣;持續投資相關的研究與設備。
延伸閱讀
重症新冠肺炎(COVID-19)的曙光!細胞治療支持療法
再生醫療決勝關鍵:生產製程自動化!
再生醫療業界共盼政府提出策略性目標